小鼠模型是结肠炎造模常见模型,自从1985年首次采用葡聚糖硫酸钠(dextran sulphate sodium, DSS)制备出仓鼠溃疡性结肠炎模型后,已有大量数据证明DSS结肠炎模型的病因、临床症状、病理改变及治疗应答均与人类溃疡性结肠炎(ulcerative colitis,UC)相似。
DSS造模优势
葡聚糖硫酸钠盐(Dextran Sulfate Sodium Salt, DSS)是一种聚阴离子衍生物,其诱导结肠炎模型的机制虽仍未十分明确,但通常认为与巨噬细胞功能失调、肠道菌群失调、DSS对结肠上皮的毒性作用、细胞因子在DSS结肠炎模型的发病中起重要作用等机制有关。
对比多种UC建模类型,DSS造模具有很大优势:
1. 症状与人类UC高度相似:可用于研究结肠炎发生机制和药效研究;
2. 成模率高:自由饮用DSS水溶液,简单易行、重复性强;
3. 可构建多种结肠炎模型:急性结肠炎、慢性结肠炎,还可以联合AOM构建结肠炎相关性癌症(CAC)模型;
4. 适用于多种属动物造模:小鼠、大鼠、斑马鱼、猪、果蝇等;
5. 安全性高:DSS可被自然生态系统降解,对环境安全。
Yeasen提供高品质DSS(Cat#60316ES):高纯度,硫含量17-19%,游离硫<0.2%,产品有大量文献数据支持。
案例1 葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎
1. 实验方案
实验动物:8周龄的BALB/c小鼠。
实验组:2.5% DSS饮用水,持续7天。
对照组:饮用水。
实验结果:小鼠发展成结肠炎,表现为结肠变薄变短且上皮糜烂和溃疡、隐窝脓肿、杯状细胞丧失、粘液层丧失和大量嗜中性粒细胞渗入固有层。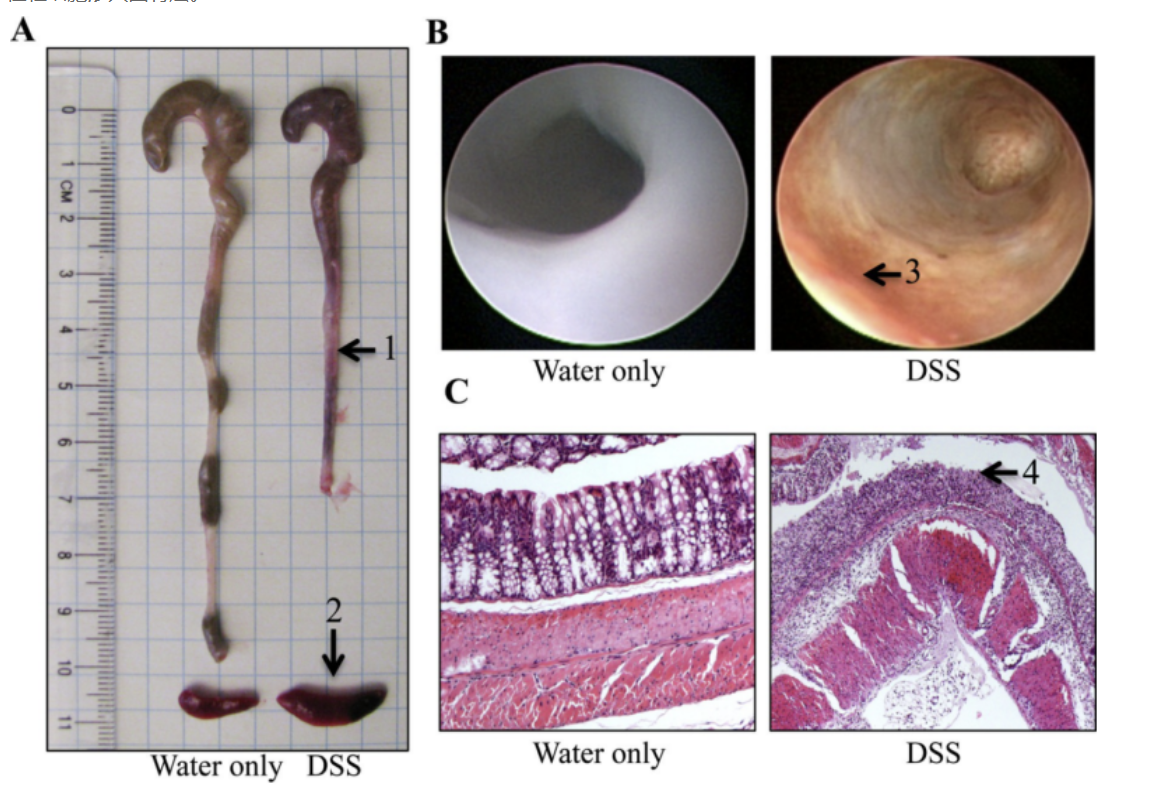
图1 DSS诱导的小鼠肠道炎症
结肠图片;B.结肠的内窥镜检查;C. H&E染色的结肠切片;
箭头指示:1. 缩短和出血的结肠;2. 脾脏肿大;3. 浅表性炎症;4. DSS处理小鼠的上皮侵蚀和免疫细胞浸润)
2. 详细实验步骤
2.1称重标记的对照组和实验小鼠组
在DSS给药的当天(第0天),应称重标记对照组和实验小鼠组;DSS给药前收集的粪便可用作检测炎症粪便标记物时的对照。用高压灭菌水制备DSS水溶液,对照组小鼠应该得到相同量的水,但不含DSS。【注】通过测量剩余水观察各组小鼠的水摄入量。
每天测量体重以及潜血的存在,用以下评分系统用于肠出血的比较分析。
|
评分 |
粪便稠度描述 |
血细胞计数描述 |
|
0分 |
正常粪便稠度 |
阴性(无血细胞) |
|
1分 |
软便 |
阳性(轻微血细胞) |
|
2分 |
大便非常软且有血痕 |
血细胞计数增加,有血痕 |
|
3分 |
水样便 |
可见直肠出血,血细胞计数高 |
2.2收集粪便
将单只小鼠放置在没有垫料的空笼子中15-30 min收集粪便。随着DSS给药的继续和炎症变得更加严重,收集所需的时间将会增加。用无菌镊子,将粪便收集在微量离心管中,并用一个小球监测潜血。【注】用于测量炎症标记物的粪便应-20℃冻存。
在开始出血的前三天,体重可能会稍微增加,然后开始逐渐减少。没有硬性规定DSS应该给药7天,需由研究者根据显著的体重减轻和血性腹泻来决定何时处死小鼠。
2.3观察结肠粘膜损伤
对DSS诱导的结肠粘膜损伤进行体内直接观察。在1.5-2.0%异氟烷麻醉下,用空气膨胀结肠后,可以看到3 cm的近端结肠,可通过评估以下内容对内窥镜损伤进行评分。
|
评分 |
结肠半透明性 |
肠壁上附着的纤维蛋白 |
粘膜颗粒性 |
血管形态 |
粪便特征 |
管腔内有无血液 |
|
0分 |
完全透明 |
无纤维蛋白附着 |
无颗粒性 |
正常 |
正常 |
无血液 |
|
1分 |
轻微半透明 |
少量纤维蛋白附着 |
轻微颗粒性 |
轻微异常 |
轻微腹泻 |
少量血液 |
|
2分 |
中度半透明 |
中量纤维蛋白附着 |
中度颗粒性 |
中度异常 |
中度腹泻 |
中量血液 |
|
3分 |
完全不透明 |
大量纤维蛋白附着 |
严重颗粒性 |
严重异常 |
严重腹泻 |
大量血液 |
2.4研究上皮细胞的增殖迁移与肠渗透性
在处死前4h和24h,可给小鼠腹膜内注射BrdU,通过对BrdU进行组织学特异性染色来监测肠上皮细胞的增殖和迁移。
处死当天,小鼠应禁食4h,灌胃给予溶于0.1 mL PBS中的FITC-Dextran(4或40 KDa,0.6 mg/g体重),3h后放血收集无溶血的血清。肠渗透性与适当稀释的血清的荧光强度相关(激发488 nm;发射520 nm),通过在小鼠血清中连续稀释已知量的FITC-Dextran来制备FITC-葡聚糖的标准曲线。
【注】为了对肠道炎症进行定量测量,可通过ELISA试剂盒测量血清角质细胞衍生趋化因子(KC)和/或脂质运载蛋白2(与疾病活动相关)。因此,KC以1:2或1:4稀释对照血清样品,脂质运载蛋白2以1:200稀释对照血清样品,来自DSS处理的小鼠的样品需要更高的稀释度。
2.5脾脏、结肠称重以及结肠长度测量
喷洒70%乙醇,通过腹部中线切口小心地打开小鼠肚子,取出脾脏。脾脏重量的增加通常与炎症和贫血的程度相关。
在收集结肠之前,如果计划研究肠系膜淋巴结的增大、表征免疫细胞群和/或分析与DSS诱导的病理学相关的肠道细菌移位,则应分离肠系膜淋巴结。
用镊子提起结肠,小心地拉,直到可以看见盲肠。将结肠和盲肠从回盲部的小肠和直肠远端的肛门中分离出来。此时,可以拍摄所有小鼠组或每组一名代表从盲肠到直肠的肠的大体照片。测量长度,拉直结肠,但不要拉伸。然后可以将结肠从盲肠中分离出来,并使用冷PBS快速冲洗以除去粪便和血液。盲肠可以废弃,因为DSS在该区域很少或没有诱导炎症。
【注】用PBS冲洗后,可以取结肠重量。根据观察到的组织消耗,严重发炎的结肠显示出重量减轻。
2.6结肠过氧化物酶(MPO)检测
结肠MPO是中性粒细胞的标志,其在组织中的浓度与中性粒细胞浸润的程度相关。称量结肠组织(50-100 mg ),并在PBS中彻底清洗,直到没有粪便物质,并在-80°C下储存,直到进行分析。
2.7qRT-PCR分析
将一片结肠(50 mg)置于RNAlater中,直到提取RNA。对于更长时间的储存,RNAlater中的组织应在-20℃下冷冻。在提取RNA的当天,从RNAlater中去除结肠,并通过标准程序提取RNA。由于已知结肠组织中的微量DSS会干扰PCR扩增,因此有必要通过氯化锂法去除所有多糖,包括DSS。
2.8组织学染色
纵向切开每一片结肠,用PBS浸湿的牙签包住,放入盒中。在10%福尔马林缓冲液中固定24h后,转移到70%乙醇中直到分析。对于使用特定抗体的特殊染色(如免疫组织化学、免疫荧光),建议将冷冻切片固定在防冻包埋介质OCT中。如果研究粘蛋白层和细菌粘附/移位,不要用PBS冲洗结肠,并浸入Carnoy溶液中,因为这可以保留粘液结构。福尔马林固定的结肠组织可以使用BrdU抗体进行BrdU染色。其次,Ki67可用于测量上皮细胞增殖。
组织学评分:可以以如下方式对H & E染色的结肠组织进行组织学评分。根据粘膜、粘膜下层和肌层/浆膜的上皮损伤和炎性浸润的程度,给每个切片分配四个分数。如果是局部性改变,都乘以1,如果是斑片状改变,都乘以2,如果是弥漫性改变,都乘以3。最后将每个结肠的4个单独得分相加,得到每个小鼠的总得分范围为0-36。
2.9体外培养洗涤的菌落
纵向切开的结肠(约1.0 cm)应在HBSS中用1.0%抗生素(青霉素和链霉素)连续清洗三次。将洗涤过的菌落置于含有1.0 mL无血清RPMI1640培养基和1.0%抗生素(青霉素和链霉素)的孔(24孔板)中,并在37°C和5.0% CO2下孵育24h。收集上清液,在4°C离心10 min,并在-80°C下储存,直到分析促炎细胞因子。
【注】DSS诱导的结肠炎的成功和可重复诱导取决于许多关键因素,包括DSS来源、批号、分子量、浓度、持续时间、小鼠品系、来源、年龄、性别和体重以及环境因素,包括动物饲养所的卫生条件。如果观察到高死亡率,表明对DSS高度敏感,应减少DSS的剂量。如果未观察到结肠炎或结肠炎较轻,表明易感性较低,应考虑增加DSS浓度/和/或持续时间。
3实验结论
DSS结肠炎模型在理解肠道炎症的病理生理学方面有很重要的作用,为活性IBD的理论和临床认识提供了依据。DSS结肠炎模型可以用来研究日益复杂的肠道环境的任何方面的贡献,或评估旨在预防或改善疾病的干预措施。DSS诱导的结肠炎模型将继续为宿主遗传、肠道先天免疫、微生物群、饮食和其他环境因素在维持胃肠道稳态之间的相互作用提供有价值的机制线索。
4其他注意事项
1)小鼠选择
成功且容易复制的DSS结肠炎诱导的最佳年龄在6-8周之间,优选8周龄。推荐C57BL/6J和BALB/c小鼠,因为它们在文献中普遍存在。
2)建议尽可能少地更换笼子
因为鼠类的粪食作用有助于关键营养物质的再循环。每天更换笼子可能会导致食物和水的消耗增加。如果任何笼子需要更换,所有组的笼子应同时更换。
3)最好在给药当天制备DSS水
DSS水应在服用前用磁力搅拌棒彻底混合并完全溶解,未溶解的盐可能会堵塞水瓶的出水口或影响水的摄入,从而可能导致错误的结果。制备DSS溶液时,最好使用高压灭菌水,对照组应该喝同样的水。
4)建议先做预实验
建议先做预实验,2-3个浓度,每个浓度2-3只小鼠,选取最佳的DSS剂量。
案例2 DSS诱导的结肠炎与脂肪组织和肝脏脂质代谢的相关研究
1实验方案
1.1 8周龄C57BL/6L雄性小鼠
实验组:1%、2%和3% 的DSS水持续7天,饮用水持续7天,共3个循环。
对照组:饮用水。
实验结果:小鼠发展成结肠炎,表现为体重显著下降和疾病活动指数(DAI)评分显示的结肠炎严重程度显著增加,DSS处理的小鼠还表现出与紧密连接功能和粘液层形成相关的基因表达显著降低,DSS处理的小鼠结肠切片显示显著的全层炎症,炎症评分增加,隐窝损伤、免疫细胞浸润到固有层以及上皮和粘膜结构的改变。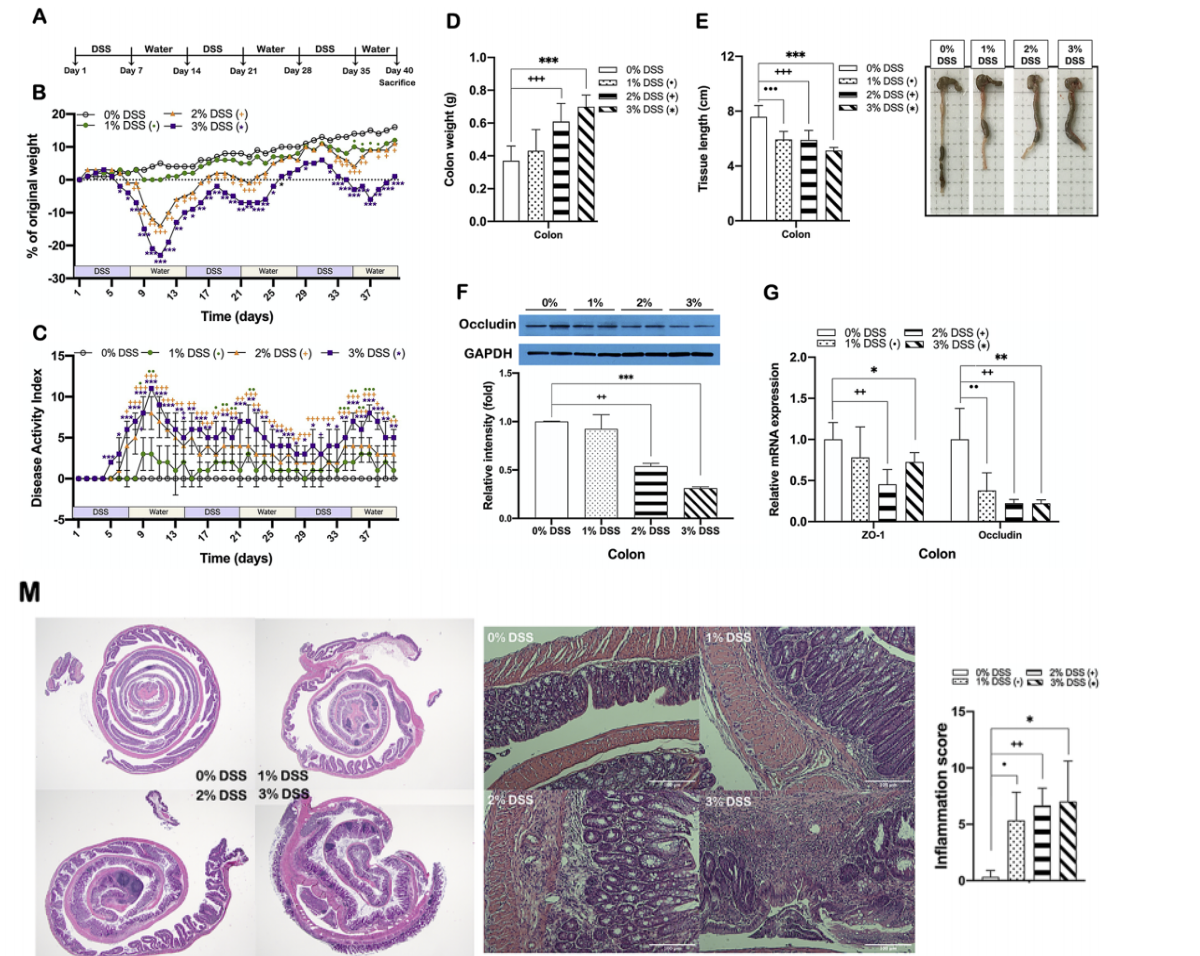
图2 DSS诱导的小鼠慢性结肠炎
(A.实验方案;B.体重变化;C.疾病活动指数(DAI)的变化;D.结肠重量;E.结肠长度;F.闭锁蛋白的蛋白表达;G.紧密连接蛋白;M.结肠段和结肠组织的H&E染色代表性图像和结肠组织以及代表炎症评分的图表)
1.2 18周龄C57BL/6L雄性小鼠
实验组:慢性DSS诱导的结肠炎组(2% DSS)和急性DSS诱导的结肠炎组(3% DSS)。对于慢性DSS诱导的结肠炎,DSS处理组需要3个周期,每个周期包含5天的DSS饮用水和5天的饮水恢复期;对于急性DSS诱导的结肠炎,小鼠接受了7天的DSS治疗,随后是3天的饮水恢复期。
对照组:饮用水。
实验结果:小鼠发展成结肠炎,表现为体重显著下降和疾病活动指数(DAI)评分显示的结肠炎严重程度显著增加,DSS处理的小鼠还表现出与紧密连接功能和粘液层形成相关的基因表达显著降低,DSS处理的小鼠结肠切片显示显著的全层炎症,炎症评分增加。
图3 DSS诱导的老年小鼠结肠炎
(A.实验方案;B.体重变化;C.疾病活动指数(DAI)的变化;J.结肠段和结肠组织的H&E染色代表性图像和结肠组织以及代表炎症评分的图表;K.小鼠的组织重量;L.肝切片H&E染色代表性图像;M.总胆固醇、高密度脂蛋白和低密度脂蛋白胆固醇水平)
2详细实验步骤
2.1 DSS诱导小鼠结肠炎模型
8周龄的小鼠设置:0(阴性对照组),1%,2%,和3%(w/v)DSS处理组。DSS处理组需要3个周期,每个周期包含7天的DSS饮用水和7天的饮水恢复期。
18周龄的雄性小鼠设置:非DSS处理对照组,慢性DSS诱导的结肠炎组(2% DSS)和急性DSS诱导的结肠炎组(3% DSS)。对于慢性DSS诱导的结肠炎,DSS处理组需要3个周期,每个周期包含5天的DSS饮用水和5天的饮水恢复期。对于急性DSS诱导的结肠炎,小鼠接受了7天的DSS治疗,随后是3天的饮水恢复期。
【注】在DSS治疗和恢复周期期间,每天记录体重、粪便硬度以及直肠或粪便中的出血情况。
2.2结肠炎严重程度的评估
2.2.1疾病活动指数(DAI)评分
DAI由体重相对下降、粪便硬度和直肠或粪便中的血液等因素决定。
体重下降评分
|
评分 |
体重变化范围 |
描述 |
|
0分 |
0% |
与初始体重相比无下降 |
|
1分 |
1-5% |
体重下降在1-5%之间 |
|
2分 |
5-10% |
体重下降在5-10%之间 |
|
3分 |
10-20% |
体重下降在10-20%之间 |
|
4分 |
>20% |
体重下降超过20% |
粪便硬度评分
|
评分 |
粪便状态描述 |
描述细节 |
|
0分 |
正常 |
固体颗粒,形状规则 |
|
1分 |
软但呈颗粒状 |
粪便较软,但仍保持颗粒状 |
|
2分 |
粪便松散但有一定固体 |
粪便结构松散,含有一些固体成分 |
|
3分 |
粪便松散有液体迹象 |
粪便松散,有明显的液体成分 |
|
4分 |
水样腹泻 |
粪便呈水样,完全无固体成分 |
直肠/粪便出血评分
|
评分 |
血液迹象描述 |
描述细节 |
|
0分 |
无血液迹象 |
粪便中无可见血液 |
|
1分 |
无出血 |
无明显出血,粪便中无血液迹象 |
|
2分 |
轻微出血 |
粪便中可见轻微的血液迹象 |
|
3分 |
血性腹泻 |
粪便中血液较多,呈现血性腹泻 |
|
4分 |
严重出血 |
粪便中血液大量,严重出血情况 |
2.2.2苏木精和伊红(H&E)染色进行组织形态学评估
新鲜结肠组织用冷PBS洗涤,纵向切成3部分,其中一部分在PBS缓冲的10%甲醛中固定,包埋在石蜡中,然后切成5 μm厚的切片进行H&E染色。使用光学显微镜观察炎症迹象、细胞浸润、纤维化以及上皮和粘膜损伤,以评分组织形态。
组织形态的评分如下:高倍视野(400×)的炎症细胞(如多形核白细胞、淋巴细胞、浆细胞、巨噬细胞和巨大细胞)数量评分:0分(正常组织);1分(罕见,1-5/phf);2分(轻微增加,5-10/phf);3分(更明显的增加);4分(显著增加,密集)。
白细胞浸润的程度评分:0分(罕见,1-5/phf);1分(固有层显著增加,5-10/phf);2分(粘膜下部分融合);3(全层浸润)。
纤维化的严重程度评分:0分(正常);1分(轻微);2分(中等);3分(严重);4分(非常严重)。
上皮损伤评分:0分(正常组织);1分(失去基底三分之一的隐窝);2分(失去基底三分之二的隐窝);3分(整个隐窝丧失);4分(局灶性侵蚀);5分(融合性侵蚀)。
粘膜损伤评分:0分(正常组织);1分(1或2个溃疡灶);2分(3或4个溃疡灶);3分(融合或广泛溃疡)。
2.2.3血浆分析
通过心脏穿刺获取新鲜血液,收集在采血管中,然后在18°C下以15000 g离心5 min,分离出的血浆在-70°C下冷冻直至分析。测量血浆中的甘油三酯(TG)、总胆固醇、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL)、AST和ALT水平,使用试剂盒测量血浆脂多糖(LPS)水平。
2.2.4实时逆转录聚合酶链反应(RT-PCR)
提取总RNA,并将2 μg提取的RNA进行逆转录合成互补DNA,使用qPCR Master Mix试剂进行实时荧光定量PCR。对酸性核糖体磷酸蛋白(Arbp)、甘油醛-3-磷酸脱氢酶(GAPDH)、ZO-1、咬合蛋白、MUC2、MUC13、白细胞介素17(IL-17)、肿瘤坏死因子α(TNFα)、IL-1β、干扰素γ(IFNγ)、IL-4、IL-6、IL-22、IL-23、F4/80、CCAAT增强子结合蛋白同源蛋白(CHOP)、脂联素、脂联素受体1(AdipoR1)、AdipoR2、载脂蛋白A1(ApoA1)、ApoB、微粒体甘油三酯转移蛋白(MTP)、肝X受体α(LXRα)、胆固醇7α-羟化酶(CYP7A1)、CYP7B1、CYP27A1、CYP8B1等的基因转录本进行定量。每个基因的相对表达水平使用ΔΔ Ct方法计算,并标准化为Arbp或GAPDH的表达。
2.2.5肝组织组织学分析
肝组织标本在10%缓冲甲醛中固定,包埋在石蜡中,切成5 μm厚度,并用苏木精和伊红(H&E)染色,在光学显微镜下以400倍放大获取图像。使用甘油三酯(TG)测定试剂盒测定肝脏中的甘油三酯(TG)水平。
2.2.6蛋白印迹分析
针对AMPK、BiP、CD36、CHOP、FAS、FGF21、HSL、咬合蛋白、磷酸化AMPK(Tr172)、磷酸化HSL(Ser563)、SCD1、UCP1、β-actin和GAPDH的抗体作为一抗,其次是抗兔IgG-HRP偶联的二抗。免疫印迹通过ECL进行可视化,并使用ImageJ软件进行密度分析。
3 实验结果
急性或慢性硫酸葡聚糖(DSS)处理的年轻和老年小鼠都发展出了结肠炎,这通过体重下降、结肠长度缩短、疾病活动指数和炎症评分升高得到证实。它们还显示出与肠道屏障功能相关的蛋白表达降低和血浆脂多糖水平升高,这表明DSS诱导的屏障功能障碍和随之而来的通透性增加。结肠炎小鼠它们呈现出肝脏内脂肪积聚以及血脂水平异常的特征。这种DSS诱导的结肠炎相关脂质代谢功能障碍是由于包括脂肪酸氧化、脂质生成、脂解、胆固醇逆向运输、胆汁酸合成以及白色脂肪组织褐变和棕色脂肪组织产热在内的整体代谢过程的破坏,这些过程大多数是通过能量稳态的关键调节因子如FGF21、脂联素和irisin,通过SIRT1/PGC-1α和LXRα依赖性途径介导的。
相关产品推荐
|
货号 |
产品名称 |
规格 |
应用场景 |
|
60316ES |
Dextran Sulfate Sodium Salt(DSS) 结肠炎建模用葡聚糖硫酸钠盐 MW:36000~50000 |
25 g/100 g/500 g/1000 g |
常被用于诱导结肠炎模型。 |
|
60751ES |
1 mg/5 mg/10 mg (液体:135 mM in Water) |
与葡聚糖硫酸钠盐DSS 一起用于结直肠癌的小鼠模型创建。 |
|
|
60736ES |
Low Density Lipoprotein Cholesterol Content Assay kit 低密度脂蛋白胆固醇(LDL-C)含量检测试剂盒(微量法) |
96T |
测定低密度脂蛋白胆固醇含量。 |
|
60737ES |
High Density Lipoprotein Cholesterol Content Assay Kit 高密度脂蛋白胆固醇(HDL-C)含量检测试剂盒(微量法) |
96T |
测定高密度脂蛋白胆固醇含量。 |
|
61220ES |
5 mg/10 mg/50 mg |
评估肠的渗透性。 |
|
|
61223ES |
5 mg/10 mg/50 mg |
评估肠的渗透性。 |
|
|
18820ES |
5 T/50 T/200 T |
能高效获得优质的粪便DNA,有利于后续对肠道微生物的研究。 |
|
|
60524ES |
2×100 mL |
用于免疫组化中组织切片,血涂片,骨髓切片的染色。 |
|
|
60403ES |
100T |
对慢性消化道出血,如:消化性溃疡等的研究筛选均具有重要价值。 |
|
|
60534ES |
6×50 mL/6×100 mL |
可鉴别同一组织中的中性黏蛋白和酸性黏蛋白。 |
|
|
41403ES |
500 mL |
最常用的缓冲溶液。 |
DSS结肠炎建模用葡聚糖硫酸钠盐MW:36000~50000发表文献(不完全统计)
[1] Zhong D, Jin K, Wang R, Chen B, Zhang J, Ren C, Chen X, Lu J, Zhou M. Microalgae-Based Hydrogel for Inflammatory Bowel Disease and Its Associated Anxiety and Depression. Adv Mater. 2024 Jan 26: e2312275. doi: 10.1002/adma.202312275. Epub ahead of print. PMID: 38277492. (IF: 29.4)
[2] Zhang Y, Tu S, Ji X, Wu J, Meng J, Gao J, Shao X, Shi S, Wang G, Qiu J, Zhang Z, Hua C, Zhang Z, Chen S, Zhang L, Zhu SJ. Dubosiella newyorkensis modulates immune tolerance in colitis via the L-lysine-activated AhR-IDO1-Kyn pathway. Nat Commun. 2024 Feb 13;15(1):1333. doi: 10.1038/s41467-024-45636-x.(IF: 16.6)
[3] Tong, L, et al. Milk-derived extracellular vesicles alleviate ulcerative colitis by regulating the gut immunity and reshaping the gut microbiota. Theranostics 2021, 11 (17), 8570-8586. DOI: 10.7150/thno.62046. (IF: 11.56)
[4] Feng X, et al. Yeast Microcapsule Mediated Natural Products Delivery for Treating Ulcerative Colitis through Anti-Inflammatory and Regulation of Macrophage Polarization. ACS Appl Mater Interfaces. 2022 Jul 13;14(27):31085-31098. doi: 10.1021/acsami.2c05642. Epub 2022 Jun 30. PMID: 35770618. (IF: 10.38)
[5] Li X, et al. Discoidin domain receptor 1(DDR1) promote intestinal barrier disruption in Ulcerative Colitis through tight junction proteins degradation and epithelium apoptosis. Pharmacol Res. 2022 Sep;183:106368. doi: 10.1016/j.phrs.2022.106368. Epub 2022 Jul 26. PMID: 35905891. (IF: 10.33)
[6] Jingjing Gan, et al. Orally administrated nucleotide-delivery particles from microfluidics for inflammatory bowel disease treatment. Applied Materials Today, Volume 25, 2021, 101231. (IF: 10.04)
参考文献
[1] Chassaing B, Aitken JD, Malleshappa M, Vijay-Kumar M. Curr Protoc Immunol.
[2] Kwon, J., Lee, C., Heo, S. et al. Sci Rep 11, 5283 (2021).
